A. Kelarutan (Solubility)
Istilah kelarutan (solubility) digunakan
untuk menyatakan jumlah maksimal zat yang dapat larut dalam sejumlah tertentu
pelarut. Kelarutan (khususnya untuk zat yang sukar larut) dinyatakan dalam
satuan mol.L–1. Jadi, kelarutan (s) sama dengan molaritas (M).
Contoh :
Ke dalam 5000 ml air dilarutkan glukosa sampai jenuh.
Ternyata massa glukosa yang terlarut adalah 9 gram glukosa (Mr=180), tentukan
kelarutan glukosa tersebut!
Jawab:
Jawab:
n = gr/Mr
n = 9/180
n = 0.05 mol
n = 9/180
n = 0.05 mol
V = 5000 ml
= 5 L
s = n/v
s = 0.05/5
s = 0.01 mol/liter
s = 0.05/5
s = 0.01 mol/liter
B. Tetapan Hasil Kali Kelarutan (Ksp)
Dalam
suatu larutan jenuh dari suatu elektrolit yang sukar larut, terdapat
kesetimbangan antara zat padat yang tidak larut dan ion-ion zat itu yang larut.
Contoh:
Tuliskan
rumus tetapan hasil kali kelarutan untuk senyawa Mg(OH)2!
Jawab:
Mg(OH)2 dalam
larutan akan terurai menjadi ion-ionnya,
C. Hubungan
Kelarutan (s) dengan Tetapan Hasil Kali Kelarutan(Ksp)
Oleh
karena s dan Ksp sama-sama dihitung pada
larutan jenuh, maka antara s dan Ksp ada hubungan
yang sangat erat. Jadi, nilai Ksp ada keterkaitannya dengan
nilai s.
Secara
umum hubungan antara kelarutan (s) dengan tetapan hasil kali kelarutan (Ksp)
untuk larutan elektrolit AxBy dapat dinyatakan sebagai
berikut.
Contoh:
Pada
suhu tertentu, kelarutan AgIO3 adalah 2 × 10–6 mol/L,
tentukan harga tetapan hasil kali kelarutannya!
Jawab:
D. Pengaruh Ion Senama terhadap
Kelarutan
Dalam
larutan jenuh Ag2CrO4 terdapat kesetimbangan antara
Ag2CrO4 padat dengan ion Ag+ dan ion
CrO42–.
Apa
yang terjadi jika ke dalam larutan jenuh tersebut ditambahkan larutan AgNO3 atau
larutan K2CrO4? Penambahan larutan AgNO3 atau
K2CrO4 akan memperbesar konsentrasi ion Ag+ atau
ion CrO42– dalam larutan.
Sesuai
asas Le Chatelier tentang pergeseran kesetimbangan, penambahan konsentrasi ion
Ag+ atau ion CrO42– akan menggeser
kesetimbangan ke kiri. Akibatnya jumlah Ag2CrO4 yang
larut menjadi berkurang. Jadi dapat disimpulkan bahwa ion senama
memperkecil kelarutan (Keenan, 1992).
Contoh
Kelarutan
Ag2CrO4 dalam air adalah 10–4 M.
Hitunglah kelarutan Ag2CrO4 dalam larutan K2CrO40,01 M!
Jawab:
E. Hubungan Ksp dengan pH
Harga pH
sering digunakan untuk menghitung Ksp suatu basa yang sukar
larut. Sebaliknya, harga Ksp suatu basa dapat digunakan untuk
menentukan pH larutan (James E. Brady, 1990).
Contoh:
Jika
larutan MgCl2 0,3 M ditetesi larutan NaOH,
pada pH berapakah endapan Mg(OH)2 mulai terbentuk? (Ksp Mg(OH)2 =
3 × 10–11)
Jawab:
F. Penggunaan
Konsep Ksp dalam Pemisahan Zat
Harga Ksp suatu
elektrolit dapat dipergunakan untuk memisahkan dua atau lebih larutan yang
bercampur dengan cara pengendapan. Proses pemisahan ini dengan menambahkan
suatu larutan elektrolit lain yang dapat berikatan dengan ion-ion dalam
campuran larutan yang akan dipisahkan. Karena setiap larutan mempunyai
kelarutan yang berbeda-beda, maka secara otomatis ada larutan yang mengendap
lebih dulu dan ada yang mengendap kemudian, sehingga masing-masing larutan
dapat dipisahkan dalam bentuk endapannya.
Misalnya
pada larutan jenuh MA berlaku persamaan:
Ksp = [M+] [A–]
Jika
larutan itu belum jenuh (MA yang terlarut masih sedikit), sudah
tentu harga [M+][A–] lebih kecil daripada
harga Ksp. Sebaliknya jika [M+][A–]
lebih besar daripada Ksp, hal ini berarti larutan itu lewat jenuh,
sehingga MA akan mengendap.
o Jika [M+] [A–]
< Ksp, maka larutan belum jenuh (tidak terjadi endapan)
o Jika [M+] [A–]
= Ksp, maka larutan tepat jenuh (tidak terjadi endapan)
o Jika [M+] [A–]
> Ksp, maka larutan lewat jenuh (terjadi endapan)
Contoh:
Jika
dalam suatu larutan terkandung Pb(NO3)2 0,05 M dan
HCl 0,05 M, dapatkah terjadi endapan PbCl2? (Ksp PbCl2 =
6,25 × 10–5)
Jawab:
[Pb2+]
= 0,05 M
[Cl–]
= 0,05 M
[Pb2+]
[Cl–]2 = 0,05 × (0,05)2
= 1,25
× 10–4

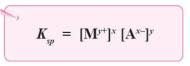












0 komentar:
Posting Komentar